土耳其的临床试验
土耳其的临床试验
国家概况
土耳其是一个被低估的适合临床试验国家。在土耳其进行临床试验有几个原因。
该国拥有庞大的人口。截至2022年12月31日,土耳其的人口为8520万,每年的增长率为0.55%。
该国的人口非常多样化。土耳其连接着中东、欧洲和亚洲,并经历了大规模的人口流动。
土耳其拥有完善的全民医疗保健系统,人均临床试验数量仍然相对较少。Statista报告称,到2020年,土耳其98.5%的人口将被公共医疗保险所覆盖,这是一个惊人的数字。这涵盖了实验室测试、药品、医疗设备、医疗咨询和许多其他服务。截至2020年,土耳其的医院总数达到了1.5千多家,包括公立、私立和大学医院。该国最大和人口最多的城市伊斯坦布尔有232家医院。
截至2020年,土耳其的公立医院总数达到900家。该国最大和人口最多的城市伊斯坦布尔有54家公立医院,而首都安卡拉的公立医院数量共计36家。
截至2020年,土耳其的私营医院总数达到566家。该国最大的城市伊斯坦布尔在同一年有162家私立医院。此外,安卡拉和伊兹密尔紧随其后,分别达到37家和30家私立医院的数量。
2020年,土耳其有超过17. 1万名卫生保健医生。自2009年以来,这一数字逐年攀升,而在所提供的时间间隔开始时,只有不到11. 9万名医生。这个比例导致2019年土耳其平均517名公民公用一个医生。
土耳其已经形成了拥有先进的医疗系统和高质量医疗服务的声誉,它是某些适应症中的十大医疗旅游目的地之一,这也是证明。
土耳其拥有一些世界上最大的城市和都市区。土耳其人口最多的城市是伊斯坦布尔,人口超过1100万。它不仅是土耳其最大的城市,也是世界上第八大城市。土耳其的第二大城市安卡拉有350万人口。土耳其还有4个居民超过100万的城市,72个居民在10万至100万之间的城市,以及424个至少有1万居民的城市。土耳其的大部分人口居住在其城市化的城市中,这使其很容易进行临床试验,因为大型临床试验基地都集中在拥有大医院和大量病人的大城市。
土耳其人口的识字率相当高,超过95%,这使得土耳其成为进行临床试验的好地方,因为大多数人都能阅读和书写。患者可以理解知情同意书,而且围绕知情同意过程不应该有任何焦虑。
土耳其在进行临床试验方面有着悠久的历史。第一次在法律文件中提到临床试验是在1926年;"第1262号医药产品和制剂法 "指出"只有在病人同意的情况下,才能在病人身上使用实验性药物"。随着《药物研究法》的出台,临床试验的现代时代开始了。这份文件直接受到ICH-GCP指南早期草案的影响,有些部分非常相似。它成为规范土耳其临床试验行为的主要文件。1995年增加了一份GCP指南文件,随后又增加了良好实验室规范(GLP)和良好生产规范(GMP)指南,也是由卫生部出版发行的。
土耳其参与了全球经济活动;所有主要的制药和生物技术公司都在土耳其有办公室,为土耳其的临床试验设定了高标准的质量。当地制药公司在开展临床试验方面与全球公司的高质量标准相匹配。该国目前有100多家制药厂,33个研发机构,反映了土耳其制药业的发达。
土耳其的生活费用相对较低。在140个国家中,土耳其的生活费用排名为125(百慕大和瑞士排名第一和第二,埃及和巴基斯坦排名为139th 和140th )。土耳其的人均收入相当低,每月825美元(作为比较,美国公民的收入为5911美元)。这使得在土耳其进行临床试验与美国和西欧相比在经济上具有吸引力。
土耳其的临床试验情况
根据clinicaltrials.gov的数据,在土耳其,由工业界、赞助商和学术界资助的临床试验,包括观察性和干预性研究的数量正在稳步增加。自2011年以来,土耳其的临床试验数量每年都在稳步增长。在2023年第一季度,试验的数量已经达到967项。
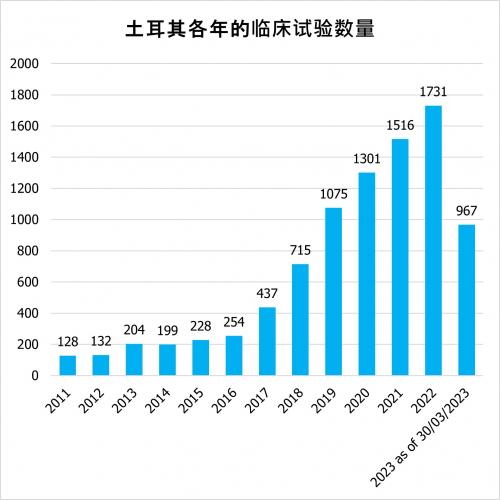
根据clinicaltrials.gov的数据,截至2023年,有2699项临床试验被注册为活跃的(尚未招募、正在招募、应邀招募、活跃、未招募)。其中,有750项干预性研究是行业赞助的试验。土耳其的临床试验各阶段的分布情况如下:
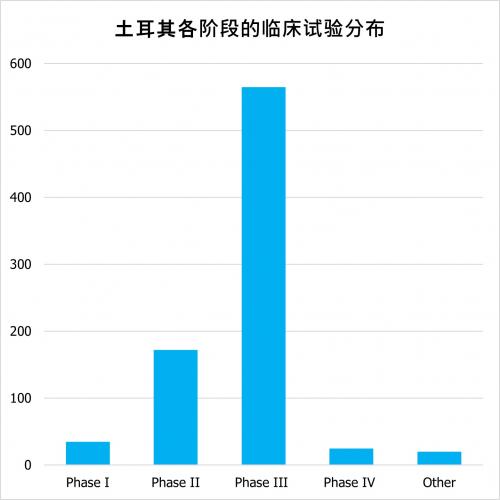
在土耳其进行的临床试验涵盖所有主要治疗领域。土耳其的临床试验还包括儿科试验。例如,截至2023年3月30日,在土耳其有83项儿科试验。
鉴于土耳其人口众多,它有足够的发展空间来增加其在全球临床研究中的份额。
土耳其可以进一步提高,成为中东和中东欧这一更广泛地区的领导者,成为全球十大临床研究国家。
土耳其临床试验的监管情况
药品和医疗器械的临床试验申请均提交给土耳其药品和医疗器械管理局(TİTCK)。
临床试验必须在专门用于临床研究的场所进行,并配备适当的工作人员、设备和实验室。
对于与药品和医疗器械有关的临床试验申请,临床试验的发起人必须首先向TİTCK和伦理委员会申请。 TİTCK和EC的批准是平行进行的。如果没有提出问题,可以在4-6周内获得TİTCK和EC的批准。
大多数文件可以用英语提交。与病人有关的文件、保险和方案概要必须以土耳其语提交。在土耳其启动临床试验,不需要提交IMPD或经过QP发布程序。
申办者也可以委托设在土耳其的合同研究组织(CRO)提交申请。
如果申办者在土耳其没有代表,临床试验申请必须通过位于土耳其的CRO提交。
向土耳其进口研究性产品和向土耳其出口样品都需要进口和出口许可证。
摘要:土耳其的临床试验
该国为临床试验建立了良好的基础设施,这也是许多申办者选择土耳其进行下一步临床试验的原因。在图克市进行临床试验的优势简述如下:
- 大的人口基数;
- 大量的地点和调查员;
- 开发了临床试验基础设施;
- 与西欧和美国相比,有兴趣参加临床试验的治疗无效的病人比例更高,而且容易获得临床试验;
- 完全遵守GCP和质量标准;
- 每个病人的研究数量少;
- 适度的临床研究费用和调查员费用;
- 临床站点集中在主要城市;
- 在土耳其启动审判不需要欧盟的QP声明;
- 在土耳其启动试验不需要IMPD;
- 不需要将临床试验文件翻译成土耳其语。
Smooth Drug
Development--土耳其的一家CRO公司
Smooth Drug
Development公司是一家在欧洲经济区、独联体、欧共体、中东和印度提供全面服务的CRO。Smooth Drug
Development公司拥有一支经验丰富的本地团队,有效地管理土耳其的临床试验。我们在土耳其经验丰富的团队在研究预算内提供卓越的数据质量和可靠的结果。
Smooth Drug
Development公司对该地区有深入的当地经验和知识,这可以转化为在土耳其的快速监管审批、快速现场签约和出色的病人招募。
如果您正在考虑在土耳其进行临床试验或与土耳其的临床研究基地进行国际研究,我们的团队将很乐意回答您关于土耳其临床试验的任何问题。
Smooth Drug
Development公司与土耳其领先的临床研究场所和现场管理组织合作。
Smooth Drug
Development公司有能力为土耳其的I-IV期试验和观察性研究提供全方位的临床试验服务:
- 项目管理
- 监管支持
- 医学写作
- 生物医学统计学
- 研究可行性
- 数据管理/IWRS
- ePRO
- eTMF/eISF服务
- 物流和仓储
- 临床监测
- 集中监控
- 医疗监测
- 药物警戒
- 中央实验室
- 患者的物流
- 临床研究报告


