Словакия
Словакия. Обзор страны
Словакия, официально Словацкая Республика, — государство в Центральной Европе. Население Словакии составляет более 5,4 миллиона человек.
Словакия является членом ЕС с 2004 года. Законодательство о клинических исследованиях было гармонизировано с ЕС. Словакия предлагает хорошие условия для проведения клинических исследований.
Количество имеющихся больничных коек в Словакии составляет около 31 016 коек. В 2020 году в Словакии насчитывалось около 20 тысяч врачей. В настоящее время в словацкой системе здравоохранения работает 31 309 медсестер. В Словакии 44 государственные больницы.
Крупнейшие города Словакии - Братислава (583 600), Кошице (355 047), Жилина (108 114), Прешов (91 352).
В 2019 году расходы на здравоохранение в Словакии составили 7,0% от ВВП, что значительно ниже, чем в среднем по ЕС (9,9%). Несмотря на этот относительно низкий уровень, доступ к здравоохранению в Словакии в целом хороший, только 2,7% населения сообщают о неудовлетворенных медицинских потребностях. В Словакии действует система обязательного социального медицинского страхования. Теоретически, охват населения является всеобщим. Небольшая часть населения (5% в 2019 году) не делает взносов и не охвачена страхованием. Расходы на здравоохранение остаются значительно ниже среднего уровня по ЕС. Более того, платежи из собственных средств пациента в Словакии состоят в основном из совместные платежей за амбулаторные рецептурные препараты и платы за медицинские услуги. Учитывая, что пациентам приходится оплачивать некоторые расходы из собственных средств, некоторые пациенты стремятся участвовать в клинических испытаниях, чтобы получить бесплатное лечение и доступ к современным лекарствам. Высокая доля собственных расходов пациентов на лекарства является давней проблемой в Словакии, поэтому пациенты заинтересованы в получении доступного доступа к новым лекарствам через клинические испытания.
Средняя зарплата в Словакии в 2021 году составляла 16 085 евро в год. Стоимость жизни составляет около 1000 евро в месяц. Уровень жизни в Словакии сопоставим с другими странами Восточной и Центральной Европы, который, как правило, ниже, чем в странах Западной Европы. Спонсоры выбирают Словакию в качестве места проведения клинических исследований из-за сравнительно низкой стоимости рабочей силы и сопутствующих клиническим исследованиям расходов.
Ишемическая болезнь сердца остается основной причиной смерти в Словакии, на нее приходится каждая четвертая смерть: четвертый по величине показатель смертности от этого заболевания в ЕС.
Смертность от рака также очень высока. В 2016 году Словакия занимала третье место в ЕС по уровню смертности от рака после Венгрии и Хорватии - более чем на 20% выше, чем в среднем по ЕС. Рак легких и колоректальный рак являются наиболее распространенными причинами смертности от рака среди словаков, хотя за последние 15 лет смертность от этих двух видов рака немного снизилась. По оценкам, около половины всех смертей в Словакии вызваны поведенческими факторами, включая диетические факторы, табакокурение, употребление алкоголя и низкую физическую активность. Высокая распространенность курения как среди взрослых, так и среди подростков остается одной из главных проблем здравоохранения в Словакии. Словакия может стать выбором для проведения клинических испытаний в сфере сердечно-сосудистых заболеваний и рака.
Исследователи имеют опыт работы по ICH GCP, хорошо обучены, мотивированы и предоставляют очень качественные данные клинических исследований.
Большинство словацких CRA являются врачами, что позволяет поддерживать отличные отношения с исследователями и получать высококачественные данные.
Условия проведения клинических испытаний
По состоянию на апрель 2023 года, сайт clinicaltrials.gov сообщает о 1992 исследованиях в Словакии. В Словакии проводится 277 интервенционных клинических исследований, спонсируемых Спонсорами. Распределение проводимых исследований по фазам выглядит следующим образом:
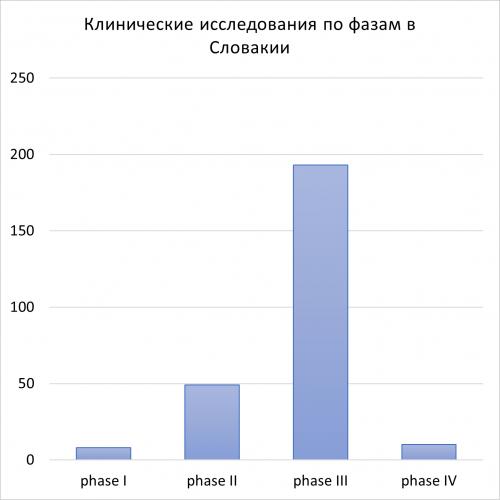
Словакия внесла вклад в
регистрацию нескольких новых лекарств в США в 2022 году. В 2022 FDA зарегистрировало 37 новых
препаратов. Клинические испытания 7 новых препаратов были проведены в Словакии.
Качество клинических
исследований в Словакии
Качество клинических исследований
в Словакии высокое. Было проведено 5 проверок FDA. Две из них закончились с результатами NAI, а три - VAI, где NAI - это отсутствие находок, а VAI - это не серьезные
находки, чтобы рекомендовать регуляторные действия.
Нормативно-правовая база в
Словакии
Словакия является членом ЕС и
поэтому полностью соответствует европейским правилам проведения клинических
исследований.
С 31 января 2022 года новый
регламент по упрощению и гармонизации клинических исследований в ЕС заменит
Директиву Европейского союза (ЕС) о клинических исследованиях 2001/20/EC (EU-CTD). Регламент ЕС о клинических исследованиях 536/2014 (EU-CTR) призван заменить EU-CTD.
Как нормативный акт, EU-CTR является обязательным для всех
государств-членов ЕС в полном объеме, что является ключевым отличием от EU-CTD. Его цель - повысить прозрачность и
восстановить конкурентоспособность клинических исследований ЕС путем снижения
административных требований и упорядочения рабочих процессов.
EU-CTR применяется к клиническим исследованиям, проводимым в одном
или нескольких государствах-членах ЕС.
Резюме. Клинические испытания
в Словакии
Словакия предлагает ряд
преимуществ для проведения клинических исследований:
- Высокое качество данных;
- Мотивированные следователи;
- Пациенты, интересующиеся клиническими испытаниями для получения доступа к современным лекарствам;
- Страна для проведения исследований в области онкологии и кардиологии;
- Прозрачные нормативные требования, гармонизированные с директивами ЕС;
- Конкурентные цены.
Компания Smooth Drug Development, имеющая
представительство в Словакии, предлагает спонсорам клинических исследований как
полный комплекс услуг, так и отдельные услуги. Мы предоставляем следующие
услуги нашим клиентам в Европе для проектов I-IV фаз
и наблюдательных программ:
- Управление проектами
- Нормативно-правовая поддержка
- Подготовка медицинской документации
- Биомедицинская статистика
- Оценка выполнимости проекта
- Управление данными / IWRS
- ePRO
- eTMF/eISF
- Логистика и хранение
- Клинический мониторинг
- Централизованный мониторинг
- Медицинский мониторинг
- Фармаконадзор
- Центральная лаборатория
- Логистика для пациентов
- Финальный Отчет
