Республика Беларусь
Беларусь. Обзор страны
Беларусь или Белоруссия как страна для проведения клинического исследования может многое предложить фармацевтическим компаниям. Беларусь, официально называемая Республикой Беларусь, является страной в Восточной Европе. Беларусь является 13-й по величине и 20-й по численности населения страной Европы с населением 9,2 миллиона человек. При таком большом населении Беларусь не насыщена конкурирующими испытаниями, что может стать возможностью для спонсоров клинических исследований.
Уровень медицинского обслуживания, предоставляемого врачами и больницами в Беларуси, выше среднего и превышает средний показатель, достигнутый в странах ЕС. В стране насчитывается 10,8 больничных коек на 1 000 жителей. Средний мировой показатель составляет 2,9 койки. В странах ЕС на 1 000 жителей приходится 4,6 койки. В целом, плотность врачей в Беларуси за этот период увеличилась. На 10 000 жителей в Беларуси приходится примерно 41 врач.
Врачи в Беларуси имеют высокую подготовку и мотивацию для работы в качестве главных исследователей (ГИ). Они владеют английским языком на среднем или продвинутом уровне и обучены GCP.
Беларусь особенно хорошо подходит для проведения испытаний в области онкологии, кардиологии, ревматологии и трансплантации, поскольку в Минске расположены крупные республиканские научные центры, специализирующиеся в этих областях. Эти центры хорошо оснащены, в них работают врачи, имеющие опыт проведения клинических исследований, и у них есть доступ к обширной базе данных пациентов - потенциальных участников исследований.
В Беларуси действует всеобщее здравоохранение. Это означает, что большинство населения имеет доступ ко многим бесплатным медицинским услугам. Министерство здравоохранения Беларуси работает над повышением доступности и качества медицинской помощи для всех без исключения граждан страны, в первую очередь через амбулаторные медицинские учреждения. Беларусь сохраняет приверженность принципу всеобщего доступа к медицинской помощи, которая предоставляется бесплатно по месту жительства в государственных учреждениях, организованных по территориальному принципу. Медицинская помощь оказывается в районных поликлиниках и республиканских центрах в городах и амбулаториях в сельской местности. При необходимости пациенты в деревнях направляются в городские центры для дальнейших консультаций и лечения. В большинстве случаев пациенты должны направляться к специалистам врачом общей практики после осмотра. Это означает, что поток пациентов в Беларуси предсказуем и пациенты сосредоточены в крупных больницах, что хорошо для проведения клинических исследований.
Фармацевтическое покрытие обычно ограничивается самыми дешевыми препаратами - как правило, местными лекарствами или дешевыми дженериками. Такая ситуация способствует тому, что среди пациентов высок процент тех, кто не имеет доступа к последними достижениями фармацевтики и стремится получить доступ к прорывным методам лечения, предлагаемым в рамках клинических испытаний. Они понимают, что этот процесс обеспечивает им более интенсивную медицинскую помощь, чем та, которая была бы доступна по государственной страховке. Участники испытаний имеют доступ к новейшим достижениям в области лечения (а не к местным дженерикам) и получают пользу от дополнительных обследований и анализов под постоянным наблюдением главного исследователя.
В стране высок процент пациентов, которые вообще не получали никакого лечения.
Городское население Беларуси составляет около 79,91%. Самые крупные города - Минск, Гомель, Могилев и Витебск. Для набора пациентов в Беларуси нет необходимости открывать исследовательские центры во многих городах.
По данным Всемирного банка, уровень грамотности среди взрослых и молодежи в Беларуси в 2019 году достиг 99,9%. Это означает, что процесс информированного согласия хорошо понятен пациентам.
Стоимость жизни в Беларуси сравнительно невысока. Средняя месячная зарплата в Минске составляет 500 долларов США. Это означает значительную экономию для спонсоров клинических исследований.
Обзор клинических исследований в Беларуси
По данным сайта clinicaltrials.gov, в Беларуси было проведено 333 исследования, из которых 90 были активны по состоянию на 04/04/2013.
По данным Белорусского реестра клинических исследований, с 2001 года было проведено 1377 исследований. Распределение по фазам следующее:
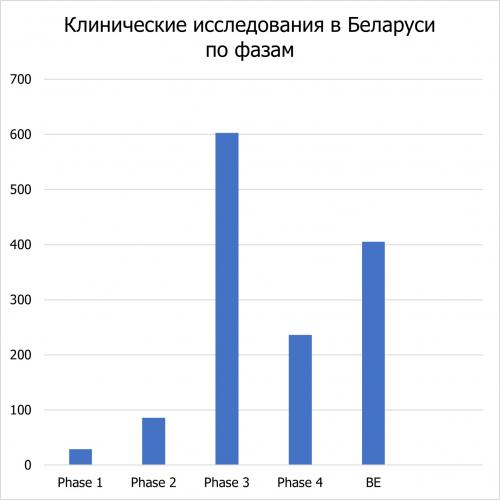
530 исследований - это национальные исследования, проводимые белорусскими фармацевтическими компаниями. 417 - клинические исследования, проводимые в Беларуси международными компаниями. 430 - многоцентровые исследования.
Нормативно-правовая база в Беларуси
Ключевым документом для проведения клинических исследований в Республике Беларусь является Постановление Министерства Здравоохранения Республики Беларусь 6 ноября 2020 г. № 94 О клинических исследованиях (испытаниях) лекарственных препаратов.
Клиническое исследование назначается решением Министерства здравоохранения, которому предшествуют: комплекс предварительных технических работ, связанных с проведением экспертиз, осуществляемый республиканским унитарным предприятием «Центр экспертиз и испытаний в здравоохранении»; одобрение проведения клинического исследования независимым этическим комитетом организации здравоохранения, на базе которой (которых) планируется проведение клинического исследования. Общий срок проведения комплекса предварительных работ не должен превышать 120 календарных дней. Указанный срок может быть продлен до 360 календарных дней по соглашению сторон. По результатам проведения комплекса предварительных работ Центром оформляется заключение о наличии (отсутствии) оснований для выдачи Министерством здравоохранения разрешения на проведение клинического исследования. Далее заключение передается в этический комитет и этическим комитетом организации здравоохранения осуществляется экспертная оценка представленных документов, материалов и информации, а также оценка квалификации исследователей и наличия условий в организации здравоохранения для проведения клинических исследований в соответствии с требованиями Правил надлежащей клинической практики на основании договора, заключенного между заявителем и организацией здравоохранения. Экспертная оценка и выдача заключения об одобрении проведения клинического исследования этическим комитетом организации здравоохранения осуществляются в порядке и сроки, предусмотренные Положением о независимом этическом комитете, утвержденным постановлением, утвердившим настоящее Положение.
Далее для получения разрешения на проведение клинического исследования заявитель после прохождения комплекса предварительных работ и проведения экспертной оценки обращается с заявлением в Министерство здравоохранения. Центр с письменного согласия заявителя предоставляет Министерству здравоохранения доступ к документам, ранее поданным заявителем в Центр для проведения комплекса предварительных работ. По результатам рассмотрения заявления Министерство здравоохранения принимает свое решение.
Основные документы для подачи в МЗ:
- Протокол исследования
- Брошюра исследователя
- Отчеты о доклинических исследованиях в объеме согласно требованиям Правил надлежащей лабораторной практики Евразийского экономического союза в сфере обращения лекарственных средств
- Индивидуальная регистрационная карта (кроме многоцентровых клинических исследований)
- Документ, выданный контрактной исследовательской организации с четко делегированными полномочиями (в том случае, если она (он) является заявителем)
- Письменная информация для субъекта исследования и форма информированного согласия
- Другая письменная информация для субъекта исследования
- Пример маркировки с информацией о лекарственном препарате на русском или белорусском языке
- Соответствующие разрешения, которые распространяются на клинические исследования или препараты, имеющие особые характеристики (если имеются), например, генетически модифицированные организмы, радиофармацевтические лекарственные препараты
- Копия ветеринарного свидетельства (декларации производителя) о неприменении в производстве исходных компонентов животного происхождения, которые потенциально могут быть инфицированы возбудителями губчатой энцефалопатии (если необходимо)
- Сертификаты качества исследуемых лекарственных препаратов
- Копия лицензии на производство, которая указывает сферу использования данной лицензии
- Информация о производителе исследуемого препарата
- Информация о технологии изготовления (производства) исследуемого лекарственного препарата и документация, согласно которой осуществлялся контроль процесса производства и контроля качества лекарственного препарата
- Письменное подтверждение, что работы на производственном участке проводятся согласно требованиям Надлежащей производственной практики
Поскольку Беларусь является членом ЕАЭС, она следует руководящим принципам ЕАЭС в отношении клинических исследований. Клинические исследования для регистрации в ЕАЭС проводятся в соответствии с требованиями ЕАЭС. Важно также отметить, что для регистрации лекарственных средств в ЕАЭС может потребоваться, чтобы пациенты были зарегистрированы в одной из стран-членов Союза. Другими странами ЕАЭС являются Россия, Армения, Казахстан, Армения, Кыргызстан.
Качество клинических исследований в Беларуси
В Беларуси было проведено 2 инспекции FDA. В результате обеих проверок не было выявлено никаких отклонений или находок (No Action Indicated). Это может означать, что клинические исследования в Беларуси проводятся с высоким качеством.
Резюме. Клинические исследования в Беларуси
Беларусь — это скрытая жемчужина, когда речь идет о клинических исследованиях. У этой страны есть ряд преимуществ, которые она может предложить:
- Высокие показатели набора пациентов благодаря высокой мотивации пациентов, три четверти из которых живут в городских центрах (соотношение аналогично Франции и Германии).
- Большое количество нелеченых пациентов.
- Большой штат мотивированных врачей с хорошим знанием английского языка, чей опыт в клинических исследованиях постоянно растет.
- Высокообразованный медицинский персонал, знакомый с надлежащей клинической практикой (GCP) (нормативный стандарт) и требованиями как Управления по контролю за продуктами и лекарствами США (FDA), так и Европейского агентства по лекарственным средствам (EMA).
- Низкая стоимость проведения КИ по сравнению с другими регионами.
- В Беларуси имеется инфраструктура для обеспечения безопасности пациентов, предоставления качественных данных и эффективной работы.
- Прозрачные нормативные требования.
- Нет требования подавать IMPD.
- Нет требования проходить процедуру выпуска препарата уполномоченным лицом.
Smooth Drug Development — CRO в Беларуси.
Как надежный партнер, мы располагаем возможностями для проведения исследований полного цикла в странах с высоким уровнем набора пациентов. Мы предоставляем полный спектр услуг по проведению клинических исследований в Европе, СНГ, ЕАЭС и Индии. Мы обеспечиваем удовлетворенность клиентов благодаря быстрому, эффективному набору пациентов по низким ценам. Компания Smooth Drug Development представлена в Беларуси. Мы можем проводить клинические исследования в Беларуси или включать белорусские центры в глобальные исследования.
