Клинические исследования в Турции
Турция. Обзор страны
Турция – недооцененная страна для проведения клинических исследований. Существует несколько причин для проведения клинических исследований в Турции.
Страна имеет большое население. По состоянию на 31 декабря 2022 года население Турции составляло 85,2 млн человек, темпы роста - 0,55% в год.
Население страны очень разнообразно. Турция связывает Ближний Восток, Европу и Азию, в Турции исторически сложились высокие темпы миграционной активности.
В Турции хорошо развита всеобщая система здравоохранения, но при этом количество клинических исследований на душу населения относительно невелико. По данным Statista, к 2020 году 98,5% населения Турции покрыто государственным медицинским страхованием. По состоянию на 2020 год общее число больниц в Турции достигло более 1,5 тысяч, включая государственные, частные и университетские больницы. В самом большом и густонаселенном городе страны, Стамбуле, насчитывается 232 больницы.
По состоянию на 2020 год общее количество государственных больниц в Турции составило 900. В самом большом и густонаселенном городе страны, Стамбуле, насчитывается 54 государственных больницы, в то время как число государственных больниц в столице Анкаре составляет 36.
По состоянию на 2020 год общее число частных больниц в Турции составило 566. В крупнейшем городе страны, Стамбуле, в том же году насчитывалось 162 частных больницы. За ним следуют Анкара и Измир, где число частных больниц достигло 37 и 30 соответственно.
В 2020 году в Турции работало более 171 тысячи врачей. С 2009 года это число ежегодно увеличивалось по сравнению с менее чем 119 тысячами врачей в начале указанного временного периода. В соотношении это приводит к тому, что на каждого врача в Турции в 2019 году приходится в среднем 517 граждан.
Турция завоевала репутацию страны с развитой медицинской системой и высококачественным здравоохранением, о чем свидетельствует тот факт, что по некоторым показателям она входит в десятку лучших направлений для медицинского туризма.
В Турции находятся одни из самых больших городов и мегаполисов в мире. Самым густонаселенным городом Турции является Стамбул, население которого составляет более 11 миллионов человек. Помимо того, что это самый большой город Турции, он также является 8-м по величине городом в мире. Население следующего по величине города Турции, Анкары, составляет 3,5 миллиона человек. В Турции есть еще четыре города с населением более одного миллиона человек, 72 города с населением от 100 000 до 1 000 000 человек и 424 города с населением не менее 10 000 человек. Большинство населения Турции проживает в городах, что облегчает проведение клинических исследований, поскольку крупные центры клинических исследований сосредоточены в больших городах с крупными больницами с большим количеством пациентов.
Уровень грамотности населения довольно высок, более 95%, что делает Турцию хорошим местом для проведения клинических испытаний, поскольку большинство населения умеет читать и писать. Пациенты могут понять процесс информированного согласия, и процесс информированного согласия не должен вызывать беспокойства у пациента.
Турция имеет долгую историю проведения клинических исследований. Первое упоминание о клинических испытаниях в юридическом документе было в 1926 году; закон «Кодекс фармацевтических продуктов и препаратов № 1262» гласил: «Экспериментальные препараты могут применяться у пациента только с его согласия». Современная эра клинических исследований началась в 1993 году с принятием Закона об исследованиях лекарственных средств. На этот документ оказали непосредственное влияние ранние проекты руководства ICH-GCP, и некоторые его части были очень похожи на текст закона. Закон стал основным документом, регулирующим проведение клинических исследований в Турции. В 1995 году был принят GCP, за которым последовали руководства по надлежащей лабораторной практике (GLP) и надлежащей производственной практике (GMP), также опубликованные и изданные Министерством здравоохранения.
Турция участвует в глобальной экономической деятельности; все основные фармацевтические и биотехнологические компании представлены в Турции, что устанавливает высокий стандарт качества клинических исследований в Турции. Местные фармацевтические компании соответствуют стандартам качества мировых компаний при проведении клинических исследований. В настоящее время в стране насчитывается более 100 фармацевтических заводов, 33 научно-исследовательских центра, что отражает хорошо развитую фармацевтическую промышленность Турции.
Стоимость жизни в Турции сравнительно низкая. Она занимает 125 место из 140 по стоимости жизни (Бемуды и Швейцария занимают первое и второе места, а Египет и Пакистан – 139 и 140). Средний доход на душу населения в Турции довольно низкий, он составляет 825 долларов США в месяц (для сравнения, граждане США зарабатывают в среднем 5 911 долларов США в месяц). Это делает Турцию финансово привлекательной для проведения клинических исследований в Турции по сравнению с США и Западной Европой.
Обзор клинических исследований в Турции
По данным сайта clinicaltrials.gov, в Турции неуклонно растет число клинических испытаний, включая обсервационные и интервенционные исследования, финансируемые спонсорами и научными учреждениями. С 2011 года наблюдается устойчивый ежегодный рост числа клинических исследований в Турции. В первом квартале 2023 года количество исследований уже достигло цифры в 967 исследований.
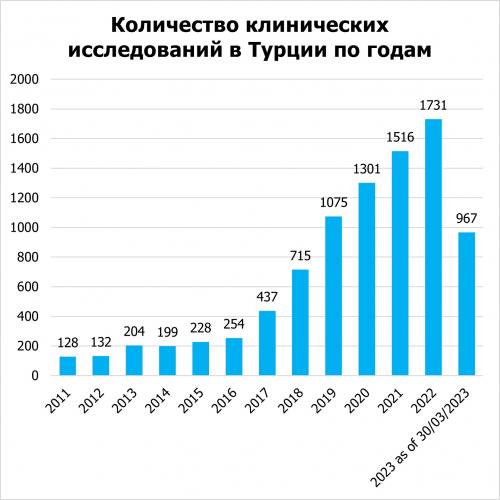
По данным сайта clinicaltrials.gov, на 2023 год зарегистрировано 2 699 клинических исследований, которые являются активными (набор пациентов еще не начался/ пациенты набираются в проект/пациенты набираются в проекты по приглашению/ пациенты набраны, но проект еще в активной фазе). Из них 750 интервенционных исследований спонсируются фарм компаниями. Распределение клинических исследований в Турции по фазам выглядит следующим образом:
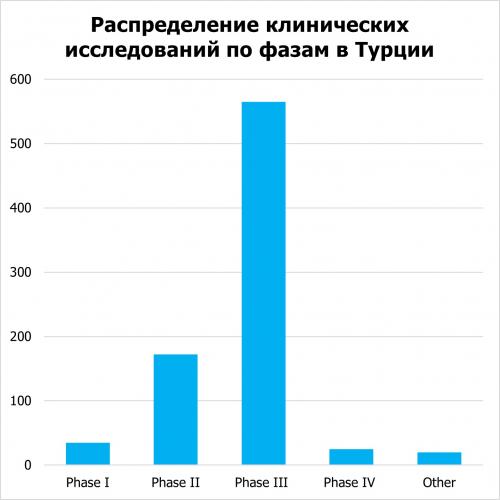
Клинические исследования, проводимые в Турции, охватывают все основные терапевтические области. Клинические исследования в Турции также включают педиатрические исследования. Например, по состоянию на 30/03/2023 в Турции было проводится 83 педиатрических исследования.
Турция имеет широкие возможности для роста, чтобы увеличить свою долю в глобальных клинических исследованиях, учитывая большое население страны.
Турция может и дальше совершенствоваться, и стать лидером в более широком регионе Ближнего Востока и Центральной и Восточной Европы, чтобы войти в десятку лучших стран мира по проведению клиническим исследованиям.
Нормативно-правовая база для проведения клинических исследований в Турции
Заявки на клинические испытания фармацевтических препаратов и медицинских изделий подаются в Турецкое агентство по фармацевтике и медицинским изделиям (TİTCK).
Клинические исследования должны проводиться в центрах, предназначенных для проведения клинических исследований, с соответствующим персоналом, оборудованием и лабораториями.
Для инициации клинического исследования спонсор клинического исследования должен сначала обратиться в TİTCK и Комитет по этике. Разрешения TİTCK и Комитета по этике выдаются параллельно. При отсутствии вопросов одобрение TİTCK и ЭК может быть получено за 4–6 недель.
Большинство документов может быть представлено на английском языке. Документация, предназначенная для пациентов, страховка и синопсис протокола должны быть представлены на турецком языке. Для начала клинического исследования в Турции нет необходимости подавать Досье на исследуемый лекарственный препарат( IMPD) или проходить процедуру проверки партии препарата уполномоченным лицом (QP release).
Спонсор также может назначить контрактную исследовательскую организацию (CRO), расположенную в Турции, для подачи заявки на одобрение клинического исследования.
Если у спонсора нет представителя в Турции, заявка на клиническое исследование должна быть подана через КИО в Турции.
Для ввоза исследуемого продукта в Турцию и вывоза образцов из Турции требуются лицензии на импорт и экспорт.
Резюме. Клинические испытания в Турции
В стране создана прекрасная инфраструктура для проведения клинических исследований, поэтому многие спонсоры выбирают Турцию для проведения своих следующих клинических исследований. Преимущества проведения клинических исследований в Турции:
- Большое население;
- Большое количество центров и исследователей;
- Развитая инфраструктура клинических исследований;
- Более высокий процент нелеченых пациентов, заинтересованных в участии в клинических исследованиях, и легкий доступ к ним по сравнению с Западной Европой и США;
- Соблюдение GCP и стандартов качества;
- Низкое количество исследований на одного пациента;
- Умеренные расходы на клинические исследования и гонорары исследователям;
- Концентрация пациентов в крупных городах;
- Для инициации исследования в Турции не требуется проверка партии препарата уполномоченным лицом;
- Для инициации исследования в Турции не требуется Досье на исследуемый лекарственный препарат (IMPD);
- Нет необходимости переводить документы клинических исследований на турецкий язык.
Smooth Drug Development — CRO в Турции
Компания Smooth Drug Development — это КИО полного спектра услуг в странах ЕАЭС, СНГ, ЕС, Ближнего Востока и Индии. Smooth Drug Development имеет опытную местную команду для эффективного управления клиническими исследованиями в Турции. Наша опытная команда в Турции обеспечивает исключительное качество данных и надежные результаты в рамках бюджета исследования.
Компания Smooth Drug Development обладает обширным опытом и знанием региона, что позволяет быстро получить одобрение регуляторных органов, быстро заключить контракты с центрами и обеспечить хороший набор пациентов в Турции.
Если вы рассматриваете возможность проведения клинических исследований в Турции или международного исследования с клиническими исследовательскими центрами в Турции, наши сотрудники будут рады ответить на любые ваши вопросы о клинических исследованиях в Турции.
Smooth Drug Development сотрудничает с ведущими клиническими исследовательскими центрами и организациями по управлению центрами в Турции.
Компания Smooth Drug Development обладает возможностями для предоставления полного спектра услуг по проведению клинических исследований I-IV фазы и обсервационных исследований в Турции:
- Управление проектом
- Регуляторная поддержка
- Разработка документации
- Биомедицинская статистика
- Выполнимость исследования
- Обработка данных
- Электронный дневник пациента
- Услуга eTMF/eISF
- Логистика и склад
- Клинический мониторинг
- Централизованный мониторинг
- Медицинский мониторинг
- Фармаконадзор в исследовании
- Центральная лаборатория
- Транспорт для пациентов
- Итоговый отчет
- Наблюдательные программы
